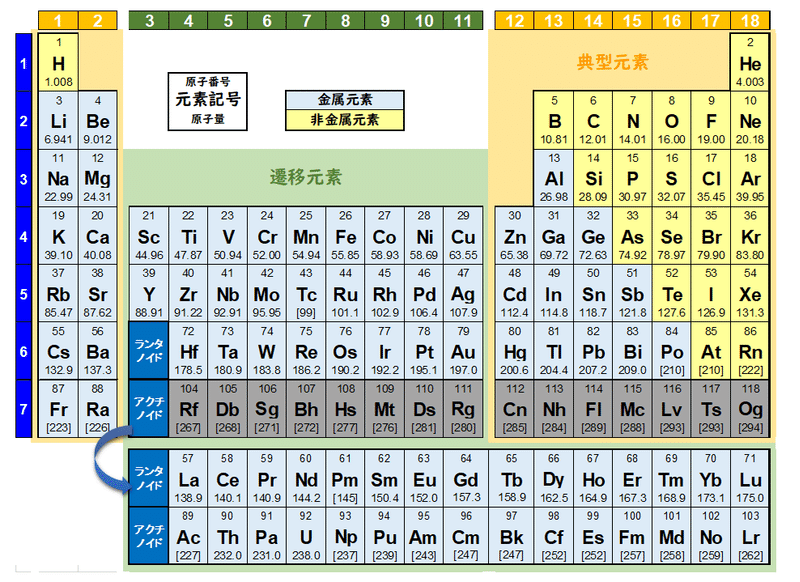
[最も共有された! √] 原子表 イオン 245135-原子表 イオン化エネルギー
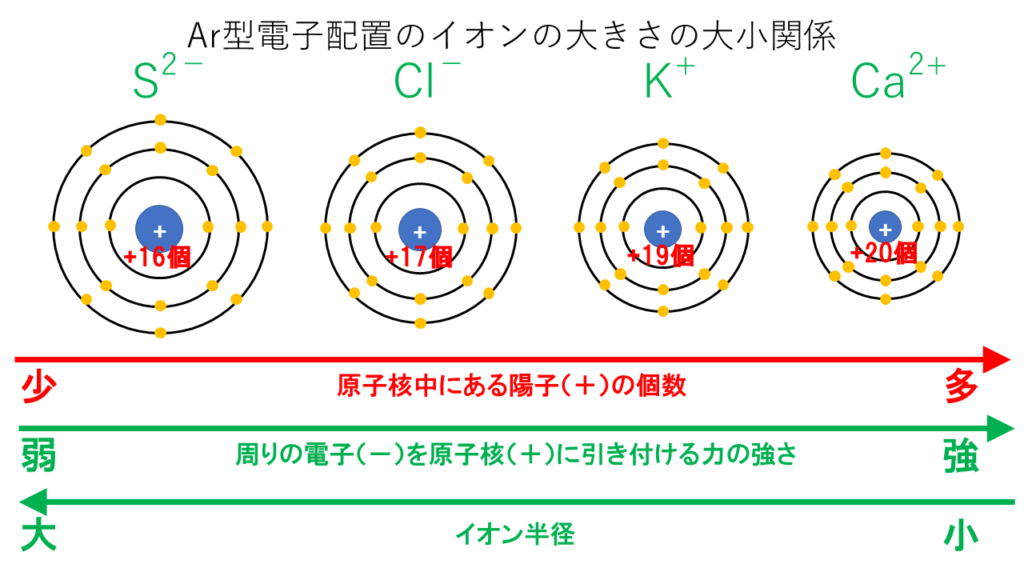
原子の実際の半径、すなわち実際の結晶や分子の中での原子間距離です。電荷を帯びた原子の存在を考慮しています。たとえば塩素 (Cl) のイオン半径は、原子半径よりも大きくなります。 原子 A と B の原子間距離は、原子半径の合計で表されます。 d AB = r A r Bイオン半径は,イオンの原子核から最外殻までの長さである。周期表では,周期が増すごとに最外殻がより外側になる。そのため,この周期表の中で最もイオン半径が大きいのは,第 3 周期の Na ~ Ar のイオンのどれかとなる。イオンに含まれている原子の数に注目しましょう。 「h 」や「cl」は1個の原子からできていますね。 このように、1個の原子からなるイオンを 「単原子イオン」 といいます。 それに対して、「nh 4 h 」や「co 3 2」は複数の原子からできています。
Q Tbn And9gcqyemsl1dnm2c45m5cggovzrdv6i2vy4na9henw 6byv1q9b2g6 Usqp Cau
原子表 イオン化エネルギー
原子表 イオン化エネルギー- 同様の考察から, Ce の 92 を 138 に, U の 1 を 240 というように,数種の元素 の原子量を訂正した。 (2) 当時,未発見の元素の性質を,周期表の縦・横の元素の関係から予測し,新元 素発見の手がかりをつくった。5 dオービタル 自由原子(イオン) 正四面体型四配位 正八面体型六配位 T2g (dxy, dyz, dxz) Eg (dz2, dx2y2) T2 (dxy, dyz, dxz) E (dz2, dx2y2) z x y y x z dd 遷移 dd 遷移 dd 遷移のエネルギー差 は可視光領域にあること が多い.金属イオン自身




高校化学基礎 物質の構成 テスト6 第1問 問題編1 映像授業のtry It トライイット
陰イオンの場合は、一般に元の原子名が「 素」の場合、「素」を抜いて「 化物イオン」という呼び名になるんだ。 ケミ太 酸素だったら酸化物イオン、ヨウ素だったらヨウ化物イオンですね。射イオンのエネルギーによって変化するこ とを利用している結 晶表面原子および第 2層以下の原子が熱振動している場合,入 射イオンのエネルギーが増加すると表面ピ ークの面積も増大するであろうも し,表 面原子の振幅が結晶内部原子のそれと異な図4:中学で覚えるイオン 図5:周期表の位置によって電気量が決まっていることを示した板書 図6:原子記号の書き方を示した板書 (3)イオンのモデル図 (10分~15分) 図7:周期表における最外殻電子のモデル図(A組)
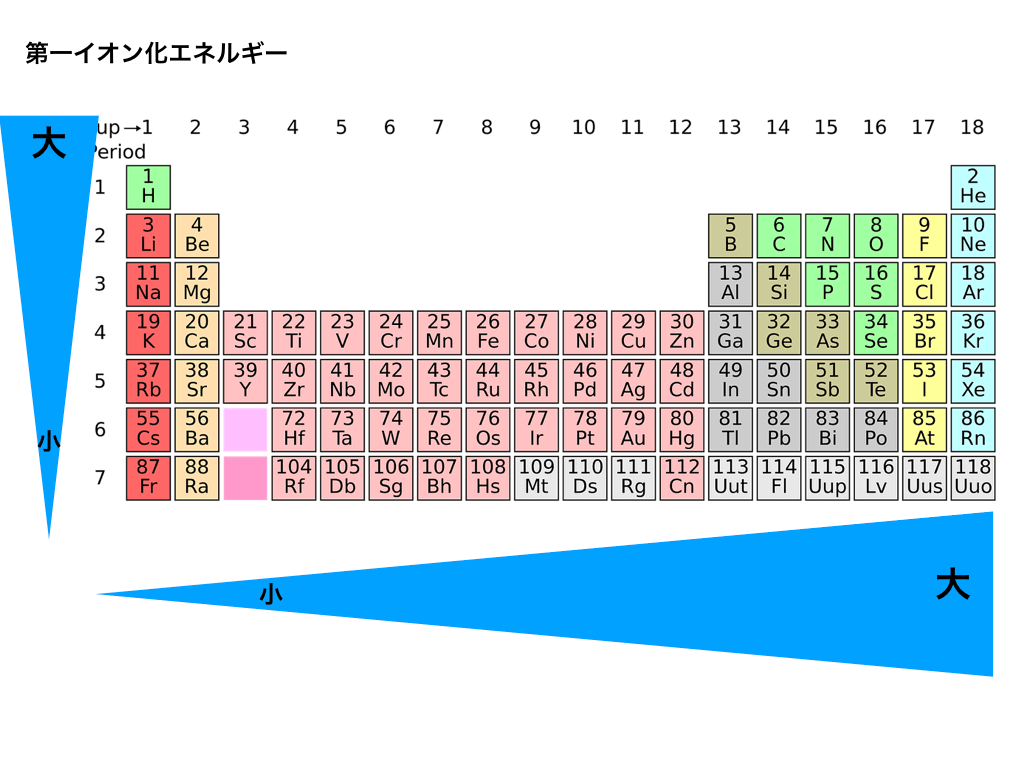
1大でイオン化困難、小でイオン化しやすい 原子番号大で極大値が切り下がっていく→軌道の広がり 細かい入れ替わりがある→閉殻、半閉殻、クーロン反発 (電子配置と密接な関係) 18 30 10 0 0 10 30 原子番号 イオン化エネルギー v) 第一イオン化エネルギー 原子番号は、原子核を構成する プロトン の数に等しい。 プロトン 化学では一般的に水素イオンのことを指すが、ここでは陽子を意味している。 プロトンの数は不変であるのに対し、 中性子 の数はある範囲で可変である。 プロトンと中性子の総和は、 質量数 (核子数 (nucleon number)) A と呼ばれる。 プロトンと中性子は、一括して 核子 (nucleon)という。 原子イオンの表 し方 イオンをイオ ン式で表す。 イオン式を用いて,的確にイオン を表している。 ワークシート 小テスト 6 イオンの生 成 イオンの生成 について理解 する。 原子がどのようにしてイオンに なるのかについて,知識を身に付 けている。
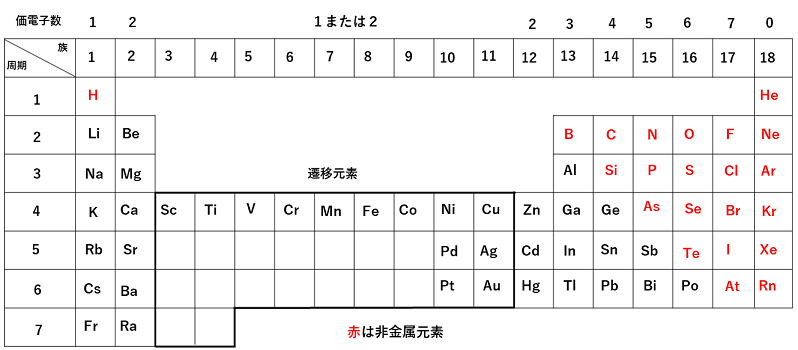
ア 水溶液とイオン (イ) 原子の成り立ちとイオン 例えば,うすい塩酸や塩化銅水溶液などの電解質の水溶液を電気分解する実験を行い,陽極と陰極に物質が生成することから,電解質の水溶液中に電気を帯びた粒子が存在することに気付かせ,イオンの価 電子:原子どうしが結びついたり,原子がイオン( 参照)になったりするときに重 要な働きを示す1~7個の最外殻電子のこと。価電子の数が等しい原子どうしは,化学的 性質がよく似ている。ページの上に戻る ©0121 NetAdvance Inc All rights reserved




高校理論化学 イオンの生成 イオン半径 イオン化エネルギーと電子親和力 受験の月




語呂合わせと徹底整理で攻略する高校無機化学 遷移元素と錯イオン篇 永野裕之のblog
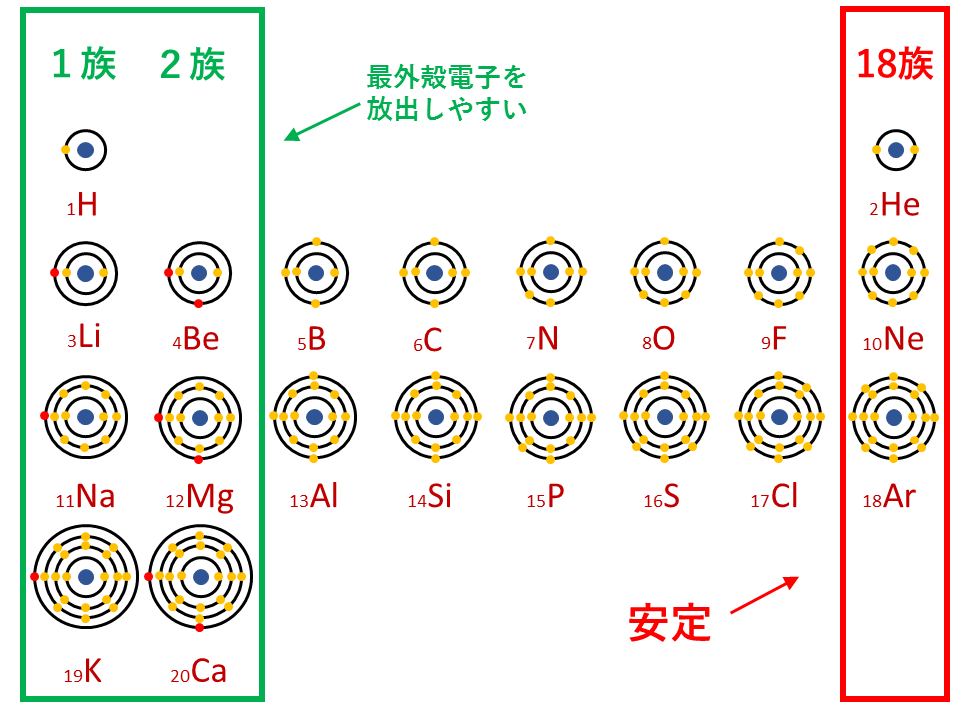
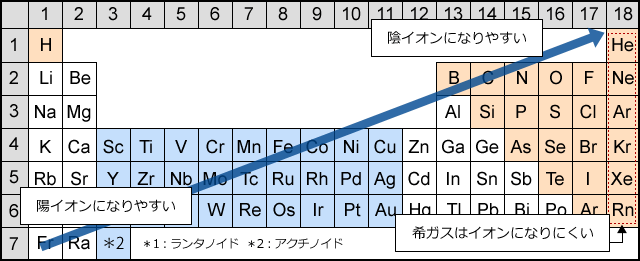
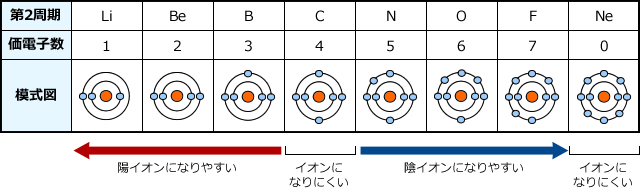
上記のイオン化エネルギーとは真逆の性質です。 原子は希ガスの状態を目指しています 18族、つまり周期表の一番右側にある希ガスについて、 ちょっと例外扱いしていますが、その理由は何でしょうか。 つまり各原子では、原子核の周りを電子が回ってい3節 イオンの電子配置と周期表 a イオンの生成 (1)イオンの生成 失う ⇒ 陽イオン 原子が電子を 受け取る ⇒ 陰イオン 原子は、なぜ、わざわざイオンになるのでしょうか? それは、原子が希ガスの持っている安定な電子配置に憧れているからです。気体状態の単原子(または分子の基底状態)の中性原子から取り去る電子が1個目の場合を 第1イオン化エネルギー (IE 1 )、2個目の電子を取り去る場合を 第2イオン化エネルギー (IE 2 )、3個目の電子を取り去る場合を 第3イオン化エネルギー (IE 3 )・・・(以下続く)と言う 。




株式会社 マテリアルハウス 金属あれこれ 周期表




周期表を描く Pymatgen Matplotlib Lan496の日記
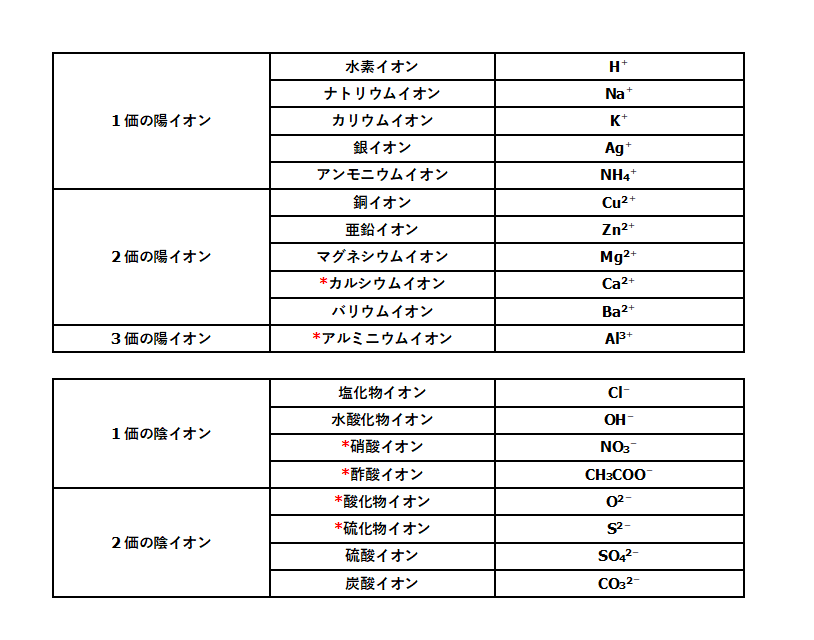
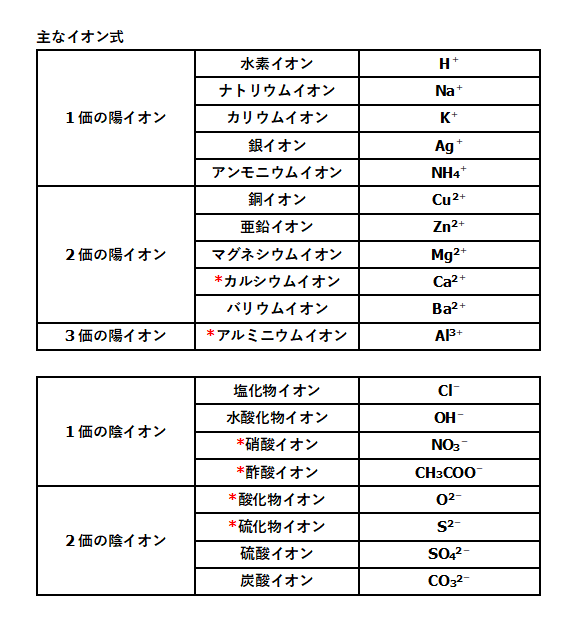
電子親和力は、周期表の右側ほど大きい(希ガスは例外) ④の原子は、第2周期に属する元素の中で 最も電子親和力が大きい原子 です。 電子親和力 とは、 電子を1つ吸収して1価の陰イオンになったとき、放出するエネルギー のことでしたね。イオン式 典型元素のイオンの電荷は,覚えていなくても周期表で分かります。 多原子イオンは,熟語みたいなものですから,覚えてしまいましょう。 <単原子陽イオン> 水素イオン H リチウムイオン Li ナトリウムイオン Na カリウムイオン K 銀イオン Agイオンの周期表(原子番号1番から番まで)/3年理科/takaの授業記録11 このページは『3年(11年度)<MrTaka 中学校理科の授業記録』です 4 イオンの周期表(原子番号1番から番まで) 11年10月上旬、普通教室 1 今日の目標 (1) 原子番号1番から番までの元素周期表の復習 (2) 同番号のイオンを覚えること 2 授業の流れ (1) 原子番号1番から番までの



周期表 Wikipedia




マイナスイオンによって健康効果が得られるメカニズム ゾンビと呼ばれた赤ちゃん
有効イオン半径(Shannon et al, Acta A 32 (1976) 751) 注:配位数が不明なものは、値の出典も不明。 アルファベット順、原子番号順イオン化エネルギー =原子またはイオンから電子を引き剥が すのに必要なエネルギー e e I:イオン化エネルギー 原子核からの距離 エネルギー 0 Hの場合:I1= eV = kJ/mol 1eV = 1602 x 1019 J 1mol = 6022 x 1023個 第一イオン化エネルギー A->A+ +e-(ポーリングの電気陰性度 χ)(表41) 電子親和力,イオン化エネルギー H 2 Li 098 Be 157 B 4 C 255 N 304 O 344 F 398



Q Tbn And9gcqyemsl1dnm2c45m5cggovzrdv6i2vy4na9henw 6byv1q9b2g6 Usqp Cau



完全版 受験で必須の単原子イオン 多原子イオンの一覧とラクな覚え方 サイエンスストック 高校化学をアニメーションで理解する
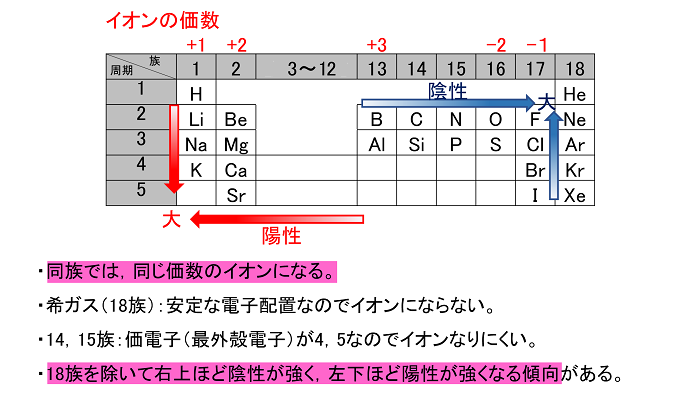
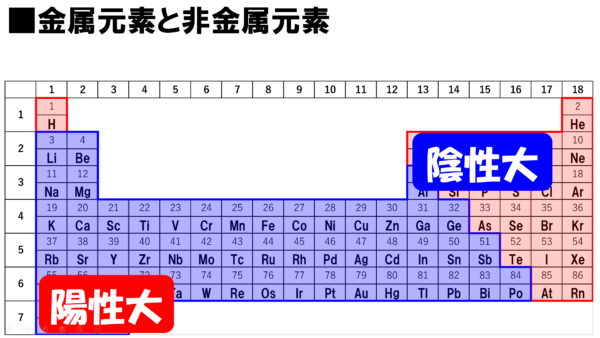
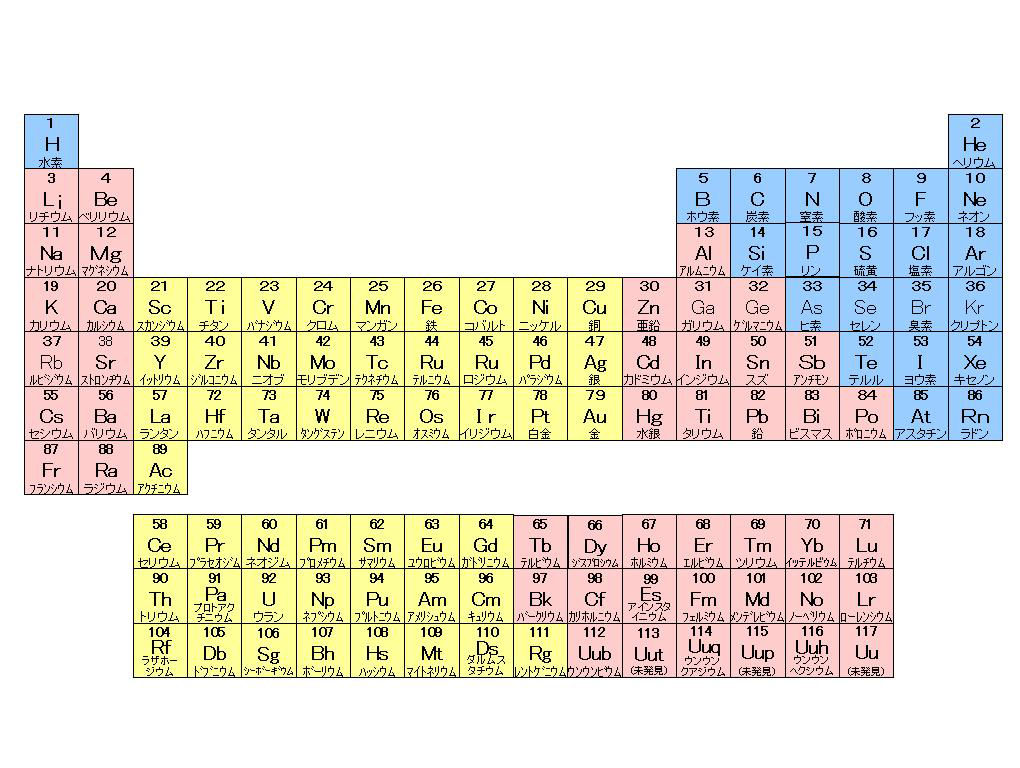
周期表とは元素を原子番号の順に並べた表ですが、似た性質の元素が縦の列に並ぶように配列されています。 この周期表の左側にあるものが陽イオンになりやすく、右側が陰イオンになりやすいものになります。 画像出典:Wiki 周期表イオン式 元素記号が,化学語の単語だとすると,単原子イオンのイオン式はその活用形だ。何度も繰り返し 覚えたか確認しよう。 ・原子番号までの単原子イオンの電荷は上記の周期表からも分かるが,原子番号21以上の主要な元「イオンができるときに、 電子を"やり取り"する数 は、 どうやって決まるのですか?」 すばらしい質問ですね! 結論から言うと、 原子番号1(H)から(Ca)までは、 周期表で分かる、 というのがお答えです。 大事な部分を、以下でお話しますね。



エレメンタッチって何 元素の立体周期表 Elementouch エレメンタッチ



中学で覚えるイオン 酸とアルカリ 3年理科 Takaの授業記録11
(3)H原子が陽イオンに,Cl原子が陰イオンになるため, H +を陰極,Cl -を陽極へ,それぞれ移動させる。 (4)陰極では,H +が電源の陰極から来た電子を1つ受け 表1 原子とイオンのモデル 例として,HとClを取り上げ る。凹凸モデルは,板書で使用 原子・分子のイオン化エネルギーを量子コンピュータで 直接計算する手法を開発! プレスリリース 化学研究に役に立つ量子アルゴリズム 論します。また、分子が大きくなったり、周期表で下の方に現れる重原子が入ったりすると全エ



受験化学基礎 9 イオン化エネルギー 電子親和力 みかみの参考書ブログ



イオン化エネルギーとイオン化傾向の違いは 定義 徹底解説



2




化学基礎 高1 物質の構成 原子の構造 イオン 高校生 化学のノート Clear 化学 高校 勉強 学習
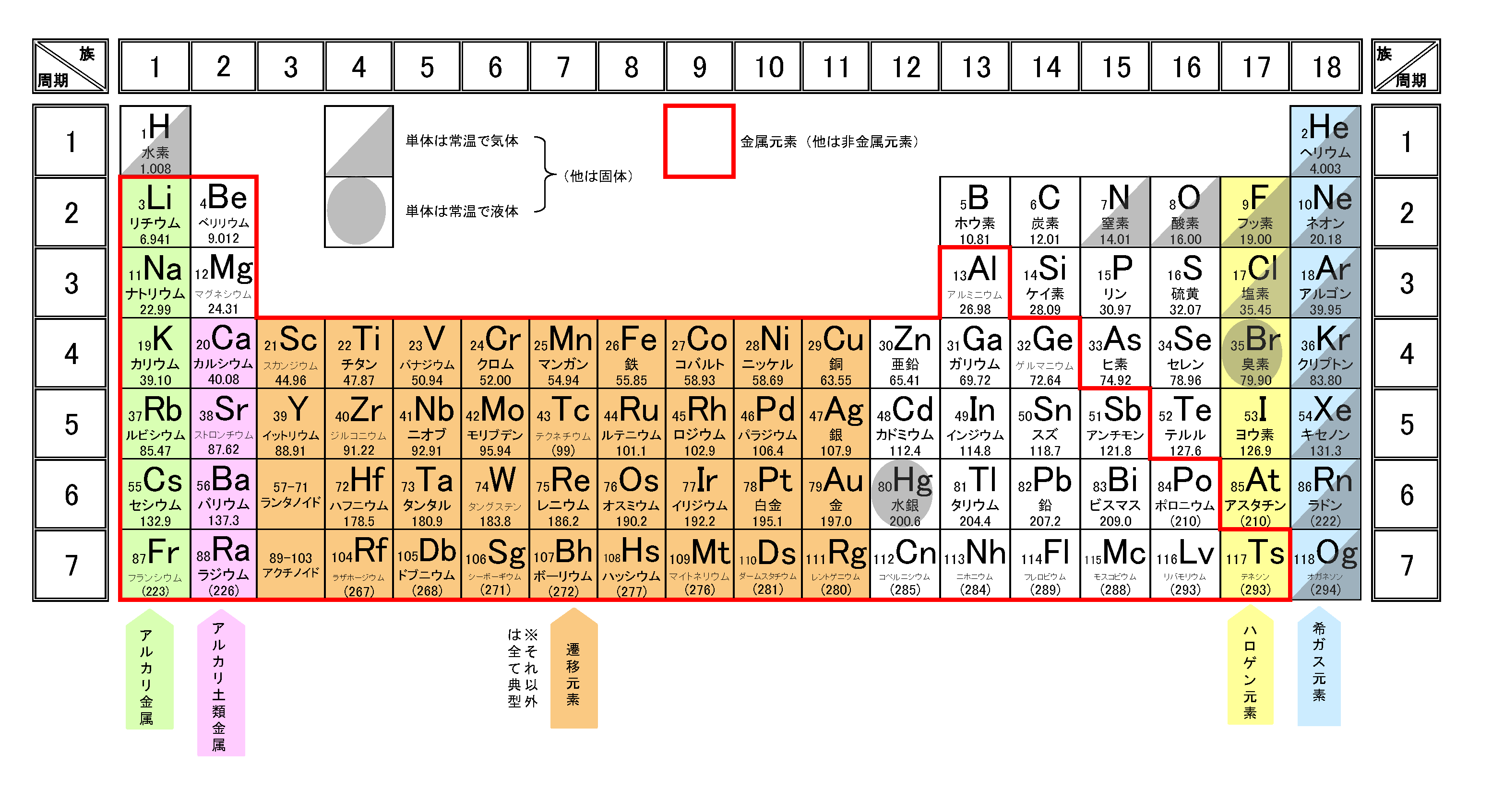



完全版 周期表の語呂合わせの覚え方と族 縦 や周期 横 の見方 サイエンスストック 高校化学をアニメーションで理解する
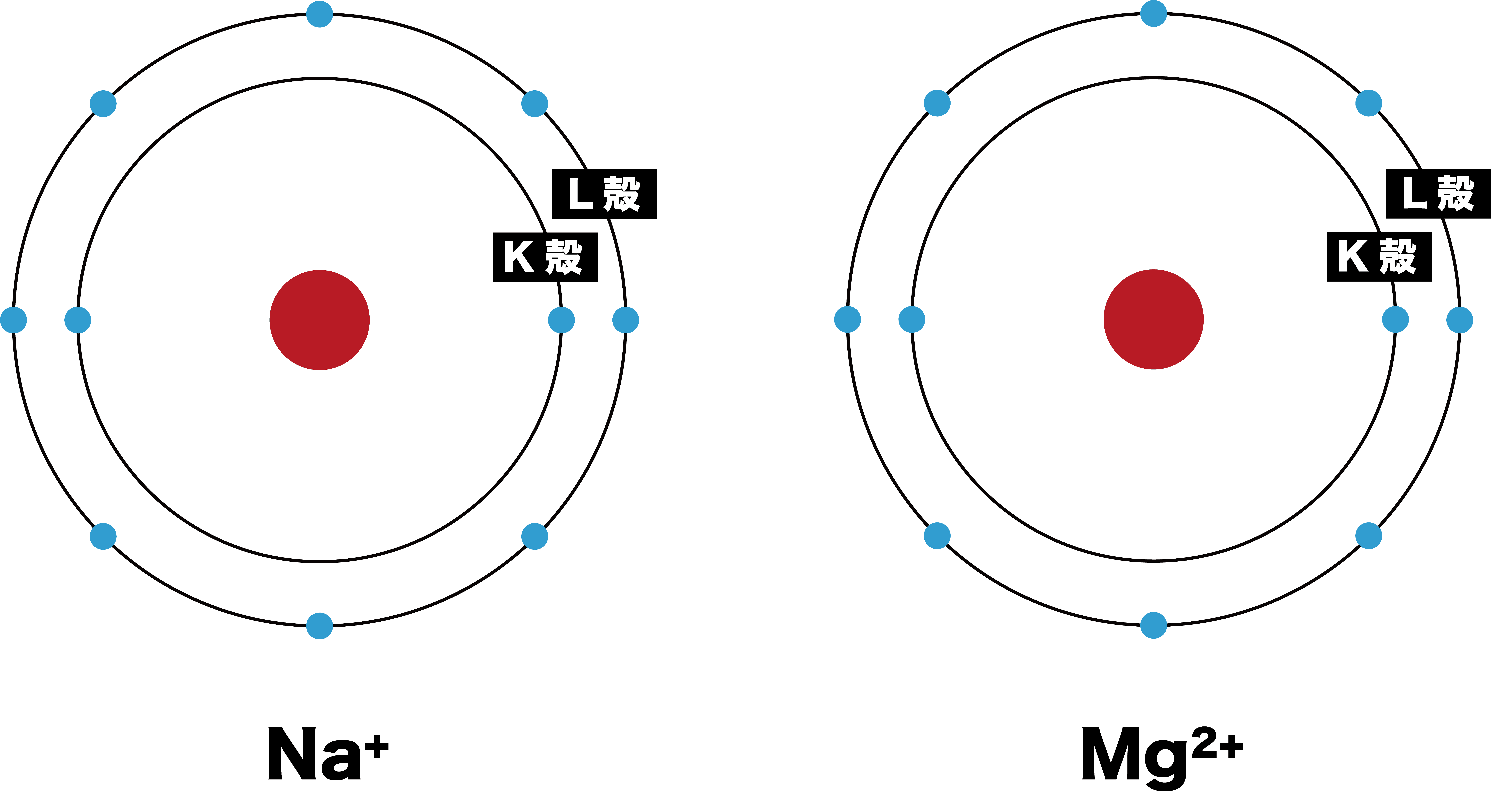



イオンの大きさ 原子の場合と異なる理由 周期表での傾向など 化学のグルメ




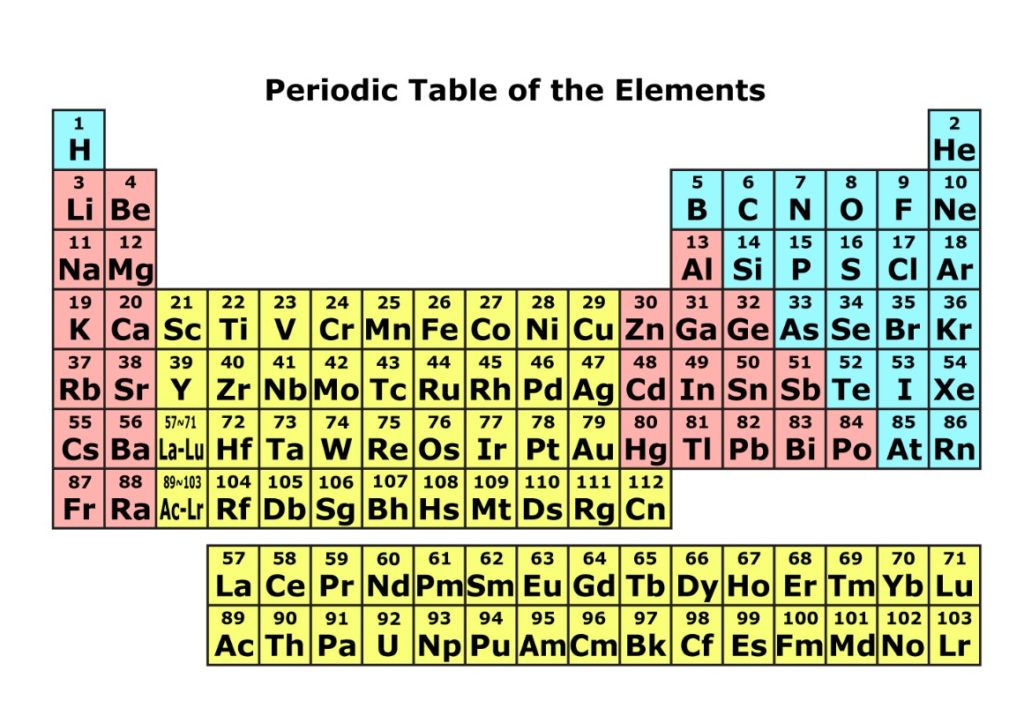
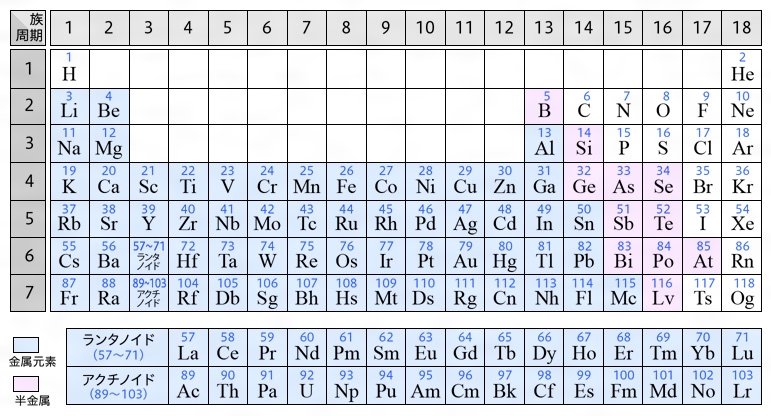
遷移元素 Wikipedia



受験基礎化学 7 周期表 みかみの参考書ブログ




元素に規則性を見つけたメンデレーエフの周期表をわかりやすく元研究員が解説 ページ 3 3 Study Z ドラゴン桜と学ぶwebマガジン




周期表の形はこれでいいのか その 1 H と He の位置 編 Chem Station ケムステ




各教科を1言で言い表すと1




高1 化学 高一 イオン 周期表など 高校生 化学のノート Clear




結晶構造可視化のためのソフトウェア Crystalmaker ヒューリンクス




高校化学基礎 物質の構成 テスト6 第1問 問題編1 映像授業のtry It トライイット
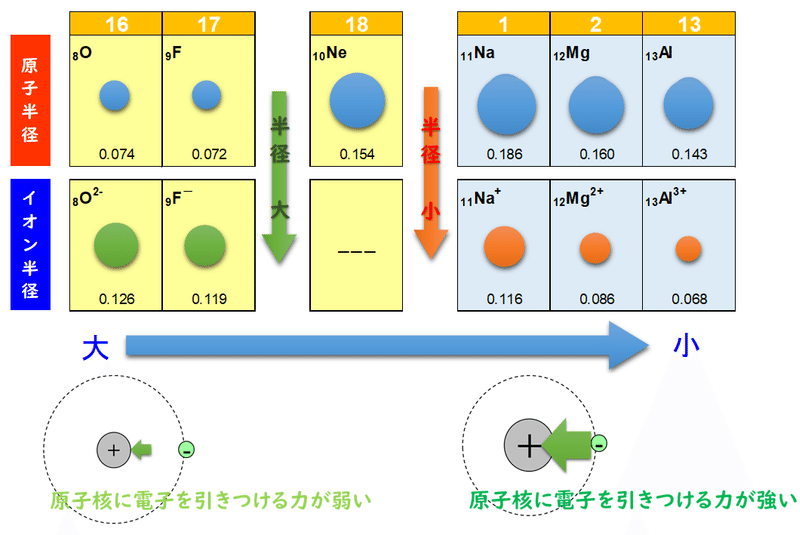



1 6 元素の周期律と周期表 おのれー Note




周期表の形はこれでいいのか その 1 H と He の位置 編 Chem Station ケムステ
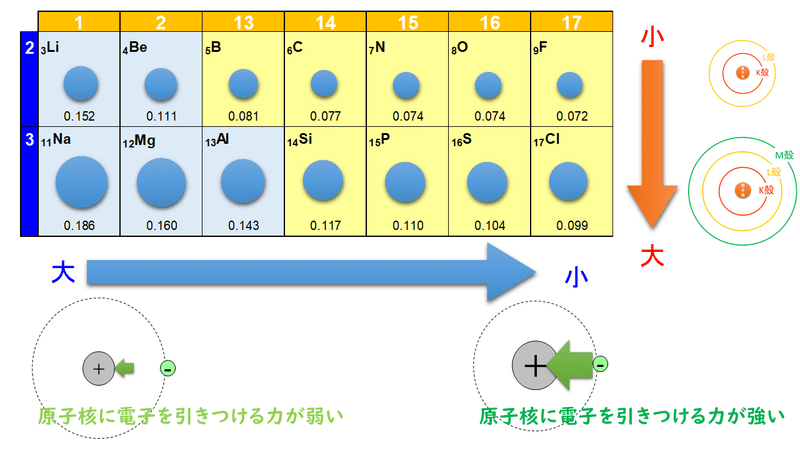



1 6 元素の周期律と周期表 おのれー Note



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム




分子を作る物質と作らない物質 3 イオン結合 楽しくチャレンジ



これで完璧 絶対に失敗しない周期表の覚え方




復習 楽しい化学 イオンの生成 Agent ジンのブログ 美意識に従え Play By Your Rules みんカラ



周期表 覚え方 語呂合わせ 族や周期の見方など 化学のグルメ




化学1章4話 イオンと周期表 byweb玉塾 Youtube




価標と原子価の違いって 受験に化学を必要とする人へ




窒素イオン N3 の部分などはなぜ斜線が引かれてあるのでしょうか 窒素イオンをイオ Clear



周期表 イオン生成




Descubre Como Resolverlo En Qanda



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム




核と電子の綱引き 原子半径とイオン化エネルギーの傾向
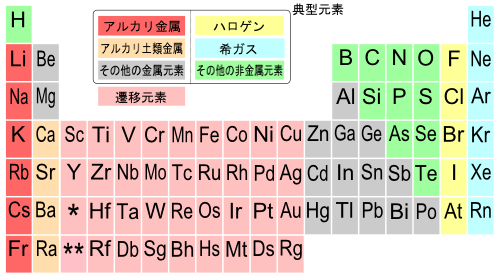



高等学校化学i 非金属元素の単体と化合物 元素と周期表 Wikibooks




原子半径とイオン半径の大きさ 理系ラボ



実習3 中学で覚えるイオン 3年理科 化学 Takaの授業記録18




中学生 理科 周期表 中学生 理科のノート Clear
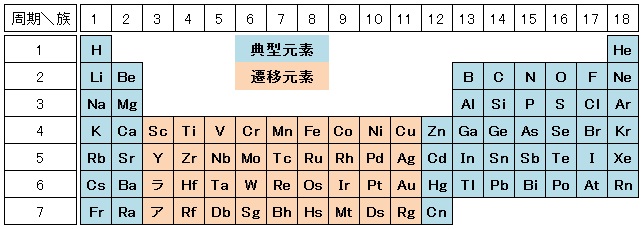



元素の分類 化学基礎 高校化学net参考書




よく出題される周期表の元素と族 化学 By しゃちょー マナペディア



07 イオン 鈴木 鉄男




高校化学基礎 金属元素と非金属元素 映像授業のtry It トライイット
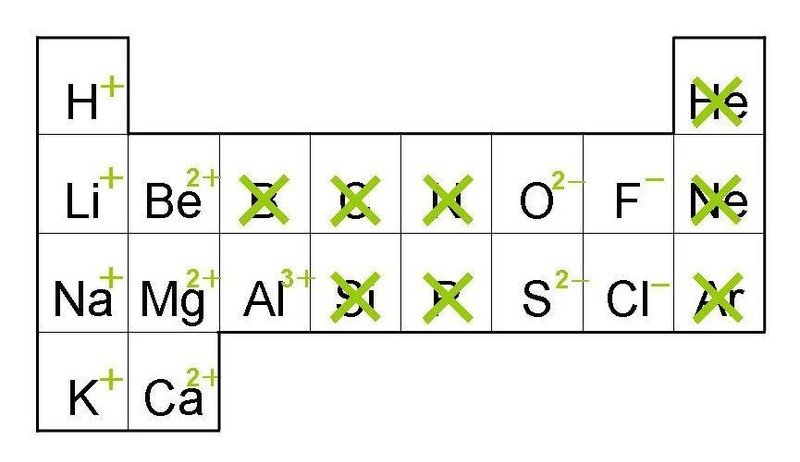



土の元素移動は とーが決める どひさん Note



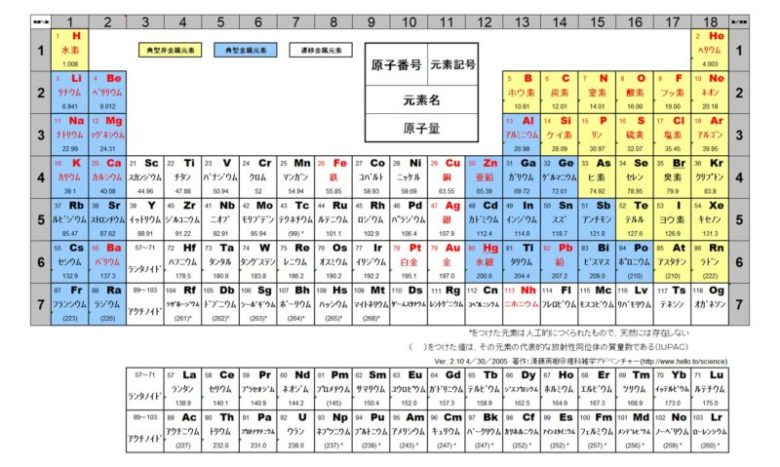
1 6 元素の周期律と周期表 おのれー Note




高校化学基礎 元素の周期表 映像授業のtry It トライイット




核と電子の綱引き 原子半径とイオン化エネルギーの傾向



Spring 8 で元素と地球をつなぐ エアロゾル中の鉄 Fe から 元素の循環 を覗く 分子地球化学 Spring 8 Web Site



モルについて




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット



Q Tbn And9gctxss1qf Ypr6mhpbzjaa Qm17kmboopvpaxrtsilso Teqcwxf Usqp Cau




この 原子の大きさ 1 2 単原子イオンの大きさ 3 4 5 Clear




イオン半径とは 大小関係を見抜くために知っておくべき2つの法則イオン半径とは 大小関係を見抜くために知っておくべき2つの法則 化学受験テクニック塾



イオン



Images Of 第12族元素 Japaneseclass Jp



イオンの周期表 原子番号1番から番まで 3年理科 Takaの授業記録11




化学 電子配置 単原子分子 Youtube



周期表と族の特徴を解説してみた 三重の個人契約家庭教師



理科ネタ 原子と元素のちがい 中学理科 ポイントまとめと整理



中3化学 イオンとは 中学理科 ポイントまとめと整理




陽イオンと陰イオンの違いと見分け方 電離とイオンの成り立ちと生成



中3化学 イオンとは 中学理科 ポイントまとめと整理



危険物資格取得のための高校化学no 8 電解質とイオン F M サイエンスブログ




化学基礎 イオンとは一体何なの イオンの形成やでき方をわかりやすく徹底解説 化学の偏差値が10アップするブログ




教養の化学 第4週 2013年10月14日 担当 杉本昭子 Ppt Download



原子とイオン




イオンの電子配置が理解できません 出来れば暗記したいので イオン 高校 教えて Goo




07 号 凹型原子 凸型原子と分子 イオン 金属モデル Astamuse




受験生 高校生必見 周期表の覚え方 スイヘーリーベだけじゃナンセンス めんまのつぶやき



1



イオンの周期表 原子番号1番から番まで 3年理科 Takaの授業記録11




1 Descubre Como Resolverlo En Qanda



イオンの周期表 原子番号1番から番まで 3年理科 Takaの授業記録11




イオンと周期表 汚泥乾燥機 スラリー乾燥機 ヒートポンプ汚泥乾燥機 Kenki Dryer



受験基礎化学 8 イオン みかみの参考書ブログ
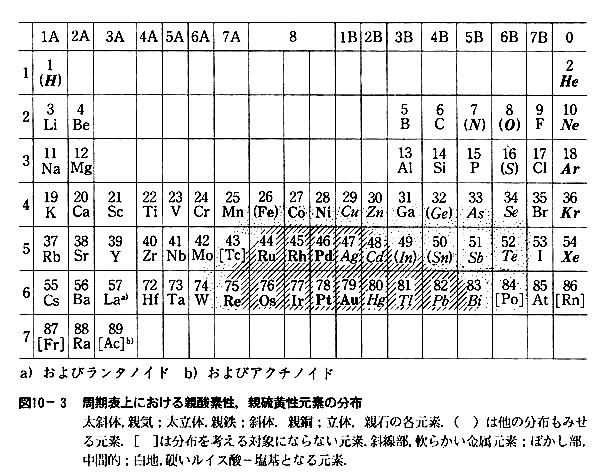



1 金属イオンの系統的定性分析



3分でわかる イオン半径 イオンの大きさ の周期表での大小関係とその理由を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する




周期表と覚え方 原子量 語呂合わせ 理系ラボ



なんとなくわかる高校化学 イオン化エネルギー



イオンのひみつ その2 武蔵義塾ようこそ



金属元素とは コトバンク




Chapter1 1
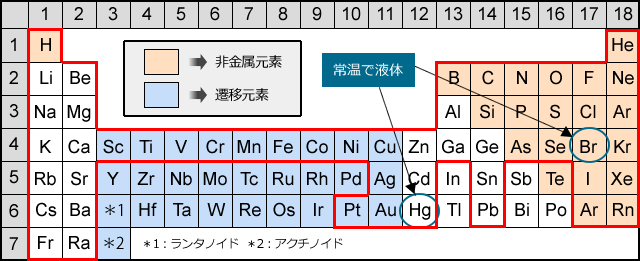



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム
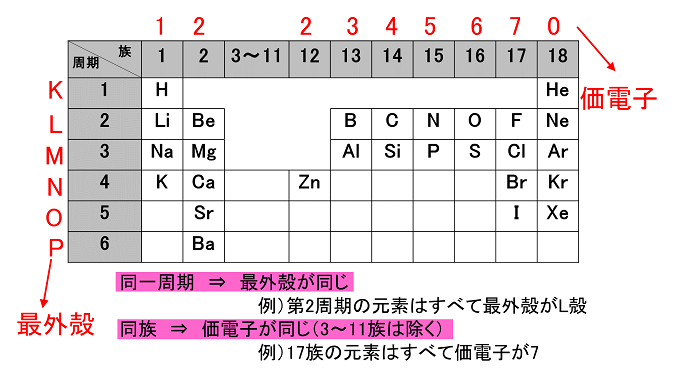



原子とイオン




5分でわかる ガリウム とはどんな元素 元家庭教師がわかりやすく解説 ページ 2 3 Study Z ドラゴン桜と学ぶwebマガジン




文系女子が教える化学 イオン化エネルギーと周期表 電子配置の関係まとめ 特許翻訳のケモノ道



元素の周期表




共有結合 極性共有結合 イオン結合 化学のススメ
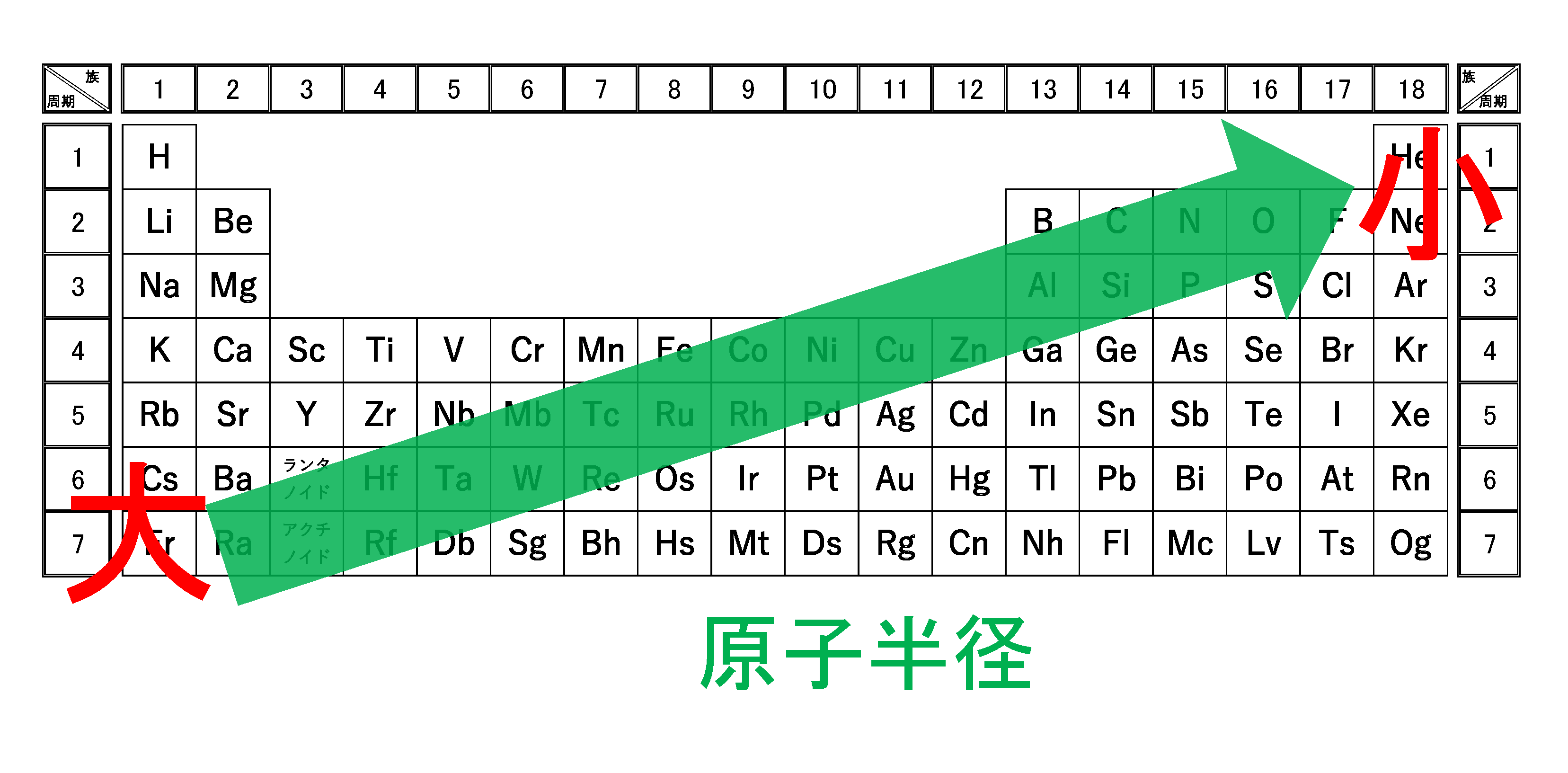



3分でわかる 原子半径 原子の大きさ の周期表での大小関係とその理由を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する



1
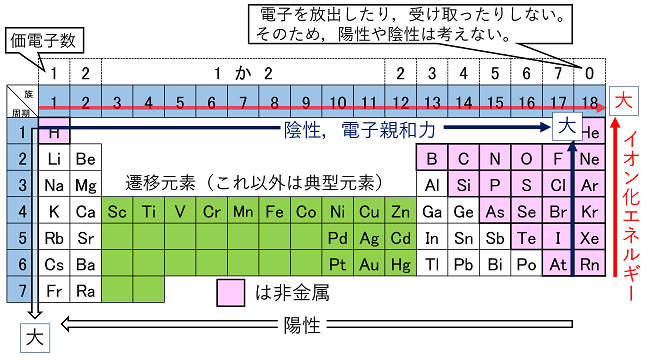



元素の種類と周期表 水素 貴ガス




元素周期表 見やすい表で覚え方と元素を解説 ゴロ合わせも 高校生向け受験応援メディア 受験のミカタ




遷移 元素 と は 無機化学 遷移元素 3属 11族元素の特徴 Amp Petmd Com




高等学校化学基礎 物質の構成 Wikibooks




原子の構造とイオン Ict教材eboard イーボード




34 4 1 See How To Solve It At Qanda



金とプラチナって何が違うの 結婚指輪の金属をもっと知りたい




01化学基礎補習 周期表の使い方 イオン 分子の形 極性 結晶の分類 Youtube
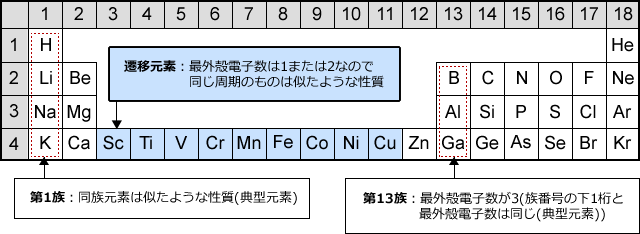



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム
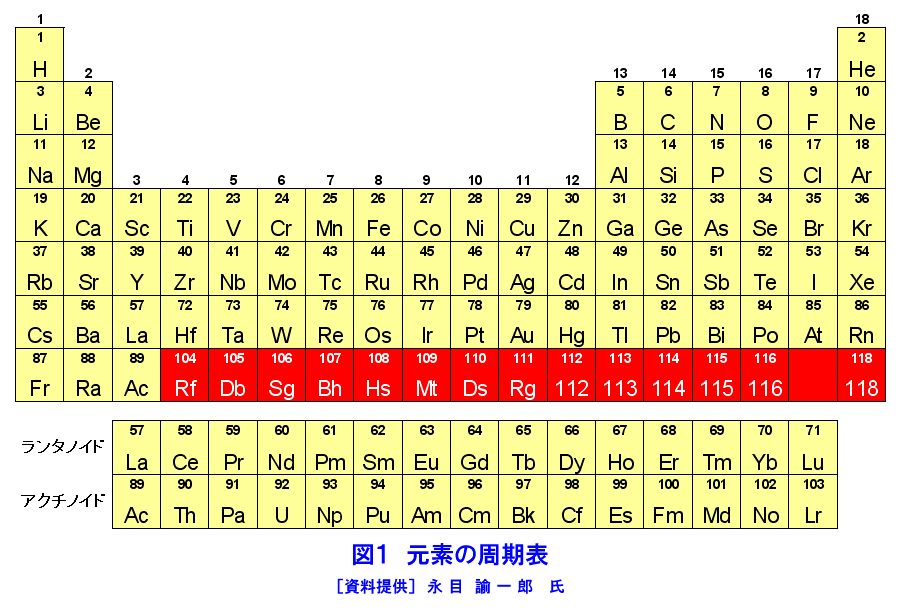



超アクチノイド元素の化学的研究 05 01 05 02 Atomica
コメント
コメントを投稿